산-염기 중화 적정은 산-염기세기에 따라서 크게 3가지로 분류한다.
1. 강산 - 약염기 적정: https://31915.tistory.com/5
2. 약산 - 강염기 적정
3. 강산 - 약염기 적정
*약산 -약염기 적정은 시행하지 않으며 불필요하다
예시를 풀기전에 필수적으로 알아야 할 두가지가 존재한다.
1. ICE 박스 풀이법. Inital Change Equlibrium의 약자로 여기서는 차례대로 적정 전, 적정 중, 분율로 해석하면 편할것이다.
2. Henderson-Hasselbalch equation: 헨더슨-하셀바흐 방정식. 완충용액의 pH를 구할때 쓰는 공식이며 이 단원에서 가장 중요한 공식이니 꼭 암기 하도록하자.
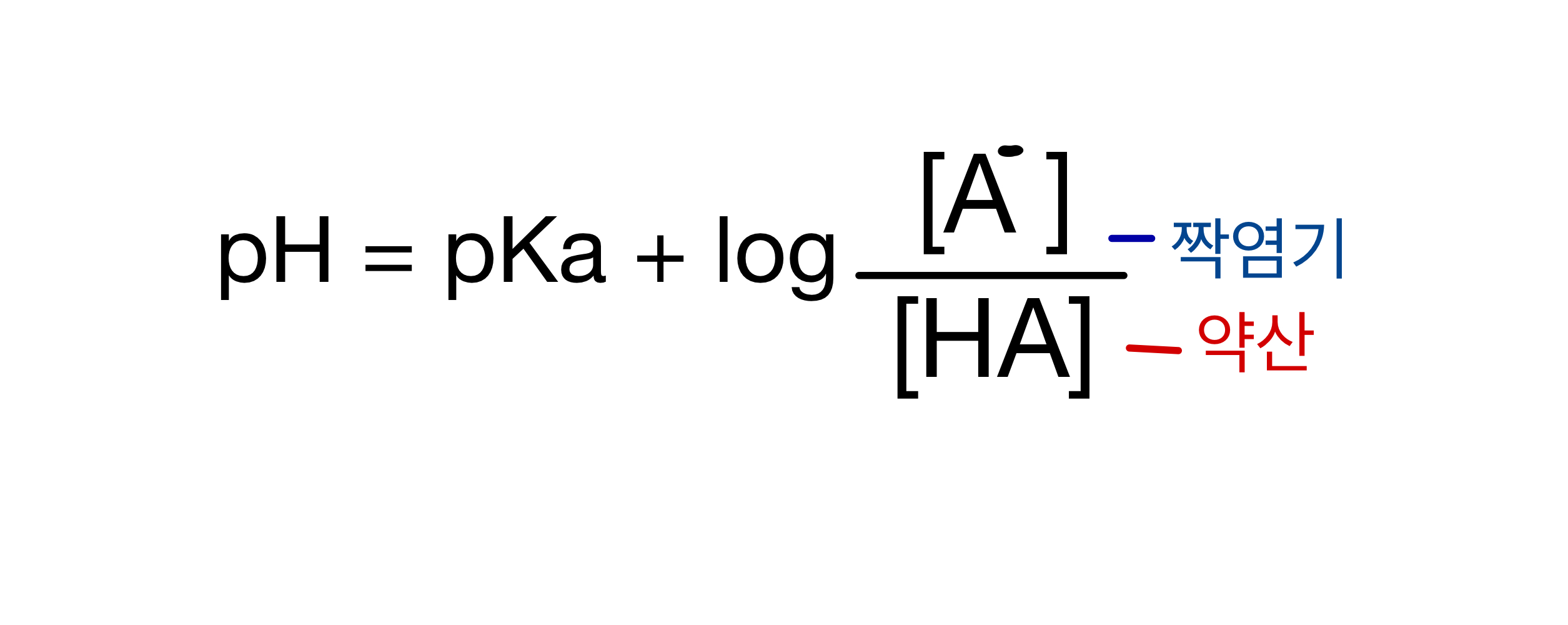
문제 예시: 0.250M의 HA 40ml를 0.200M NaOH로 적정했다고 가정하자. HA의 Ka = 3.5 *10^-4; pKa = 3.46
a) 염기 10 ml 첨가 후 pH는?
| HA | NaOH ---> | NaA | |
| I | 10 mmol | 2 mmol | 0 |
| C | -2 | -2 | +2 |
| E | 8 mmol | 0 | 2 mmol |
약식으로 ICE 박스로 정리 하여 최종적으로 남은 약산과 짝염기의 농도를 구할수 있게 되었다.
초기 농도(M)과 주어진 부피를 곱하여 mmol 단위를 구했다. (mmol/ml = M)
총 용액의 부피는 40 + 10 = 50ml 로 남은 몰수에 나눠주면 몰농도를 구할수 있지만 어짜피 같은 값으로 나눠주기에 생략가능하다.
정리해서 HH식에 그대로 대입하면
pH = 3.46 + log 2 mmol / 8 mmol = 2.86 이 나온다.
b) 반당량점 지점; pH 와 필요한 염기의 ml는?
결론 부터 말하면 이 지점에서 pH는 pKa와 동일하다. 즉 약산과 짝염기의 비율이 1: 1이여야 하며 log 짝염기/약산 값이 0 이라는 뜻이다.
이걸이용하면 초기 약산의 몰 10mmol이 절반이 소모되고 짝염기는 그 절반만큼 생성되었다는 뜻이니
| HA | NaOH --> | NaA | |
| I | 10mmol | 5mmol | 0 |
| C | -5 | -5 | +5 |
| E | 5mmol | 0 | 5mmol |
이런식으로 짝염기와 약산의 몰농도가 같아진다.
그렇다면 여기 사용된 염기의 계산은 간단한 공식을 사용하면 된다.
시료 농도 계산에 필요한 공식. aMV = bM’V’. a 와 b는 1이니
0.25M* 40ml = 0.20M * ?ml
? = 25ml 로 구할수 있다.
c) 당량점; 염기 50ml 첨가
| HA | NaOH --> | NaA | |
| I | 10 mmol | 10 mmol | 0 |
| C | -10 | -10 | +10 |
| E | 0 | 0 | 10mmol |
0.20M * 50ml = 10mmol 의 염기 즉 초기 약산의 몰과 동일하게 첨가되어 모든 약산이 반응하여 그만큼의 짝산 생성된 상태입니다.
이렇게 생성된 짝산은 다시 물과 반응 하여 수산화 이온을 생성합니다.
| A^- | H2O --> | HA | OH | |
| I | 10mmol/ 90ml | 0 | 0 | |
| C | -x | +x | +x | |
| E | 0.11M-x | x | x |
여기서 수산화 이온이 생성되었으니 Kb를 이용하여 수산화이온의 농도 즉 x 값을 구하여 pOH를 구한뒤 pH를 유도하면 됩니다.
Kb = Ka/Kw = x²/ 0.11-x;
Kb = 2.86 × 10^-11 (값이 매우 적어 5% 근사를 이용하여 계산 합니다)
x = [OH^-] = 1.8*10^-6, pOH = -log (1.8*10^-6)
pH = 14 + log (1.8*10^-6) = 8.25
d) 당량점 이후; 과량의(80ml) 염기 첨가
4가지 상황중 가장 쉽다고 생각한다.
80ml의 염기가 첨가 되었으니 80ml * 0.20M = 16mmol의 염기가 첨가 된 것이고. 초기 약산 10mmol과 반응 해도 6mmol이 남는다.
*과량의 NaOH 6mmol은 강염기 이며 100% 해리한다.
즉 생성된 10mmol의 약산은 무시할것이며 순전히 남은 강염기로만 pH를 계산하면 된다.
6mmol/ 120 ml = 0.05 M = [OH^-]
pOH = 1.3
pH = 14- 1.3 = 12.7
'일반화학 > 산-염기' 카테고리의 다른 글
| 산의 세기 3 (0) | 2022.10.05 |
|---|---|
| 산의 세기 2 - 공명 (resonance structure) (0) | 2022.10.05 |
| 산의 세기 1 ★ (0) | 2022.10.03 |
| 여러 가지 산의 pKa (0) | 2022.10.01 |
| 산-염기 중화 적정 1 - 강산 - 강염기 적정 (0) | 2022.08.15 |



댓글